हाइड्रोजन कैसे प्राप्त करें?
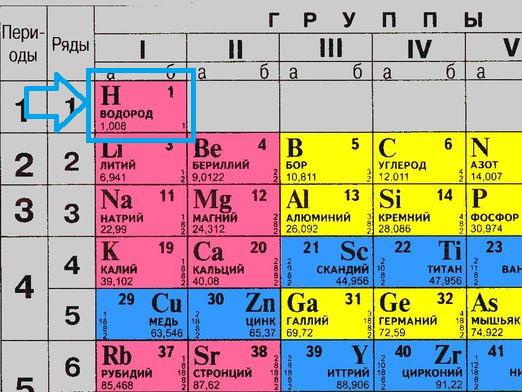
हाइड्रोजन का उत्पादन मुख्य में से एक हैहाइड्रोजन ऊर्जा के चेन बनाने शुद्ध रूप में हाइड्रोजन, प्रकृति में व्यावहारिक रूप से प्रतीत नहीं होता है, इसलिए इसे विभिन्न तरीकों और विधियों द्वारा अन्य रसायनों से निकाला जाना चाहिए।
हाइड्रोजन कैसे प्राप्त करें: विधि
- मीथेन और प्राकृतिक गैस का भाप रूपांतरण: उत्प्रेरक एजेंट की उपस्थिति में, उच्च तापमान पर जल वाष्प (700-1000 डिग्री सेल्सियस) मिथेन के दबाव में मिलाया जाता है।
- कोयला गैसीकरण: हाइड्रोजन का उत्पादन करने के सबसे पुराने तरीकों में से एक। पानी की वाष्प के साथ 800 से 1300 डिग्री सेल्सियस तापीय कोयले के तापमान पर हवा तक पहुंचने के बिना, जबकि पानी से कोयला ऑक्सीजन को विस्थापित करता है। उत्पादन कार्बन डाइऑक्साइड और हाइड्रोजन है।
- पानी का इलेक्ट्रोलिसिस: हाइड्रोजन का उत्पादन करने का एक बहुत आसान तरीका। सोडा का एक समाधान कंटेनर में डाला जाता है, जिसमें 2 इलेक्ट्रिक तत्व रखे जाते हैं, एक नकारात्मक से मेल खाती है - कैथोड, एक और प्लस एनोोड है इस समाधान में, बिजली की आपूर्ति की जाती है, जो कि घटकों में पानी को कम करता है - कैथोड में हाइड्रोजन जारी किया जाता है, और एनोड पर ऑक्सीजन होता है।
- पाइरोलिसिस: वायु तक पहुंचने और उच्च तापमान पर हाइड्रोजन और ऑक्सीजन में पानी का विघटन।
- आंशिक ऑक्सीकरण: एल्यूमीनियम और गैलियम धातुओं के एक मिश्र धातु का गठन विशेष विटाओं में होता है जो कि एक कंटेनर में पानी के साथ रखा जाता है, क्योंकि रासायनिक प्रतिक्रिया के परिणामस्वरूप हाइड्रोजन और एल्यूमिना का गठन होता है। एल्यूमीनियम के ऑक्सीकरण को रोकने के लिए गैलियम का उपयोग मिश्र धातु में किया जाता है।
- जैव प्रौद्योगिकी: 20 वीं शताब्दी में यह पता चला था कि यदि शैवाल क्लैमाडोनोड्स में महत्वपूर्ण गतिविधि की प्रक्रिया में पर्याप्त ऑक्सीजन और सल्फर नहीं है, तो वे हाइड्रोजन को सख्ती से शुरू करना शुरू करेंगे।
- ग्रह की गहरी गैस: पृथ्वी हाइड्रोजन की गहराई में एक शुद्ध गैसीय रूप में हो सकता है, लेकिन इसके विकास से यह लाभदायक नहीं है।
पानी से हाइड्रोजन कैसे प्राप्त करें
हाइड्रोजन का उत्पादन करने का सबसे आसान तरीकापानी इलेक्ट्रोलिसिस है इलेक्ट्रोलिसिस एक रासायनिक प्रक्रिया है जिसमें विद्युत प्रवाह के प्रभाव के तहत इलेक्ट्रोलाइट समाधान घटक भागों में विभाजित है, अर्थात हमारे मामले में पानी हाइड्रोजन और ऑक्सीजन में विभाजित है। ऐसा करने के लिए, पानी में सोडा का एक समाधान और दो तत्व - कैथोड और एनोड, जिस पर गैसों को जारी किया जाएगा। तत्वों को वोल्टेज के साथ आपूर्ति की जाती है, कैथोड में ऑक्सीजन को छोड़ दिया जाता है, और हाइड्रोजन होता है।
घर पर हाइड्रोजन कैसे प्राप्त करें
अभिकर्मक काफी सरल उपयोग किया जाता है - विट्रियल(तांबा), टेबल नमक, एल्यूमीनियम और पानी। एल्यूमिनियम को बियर के डिब्बे से लिया जा सकता है, लेकिन इससे पहले, प्लास्टिक की फिल्म से छुटकारा पाने के लिए जला दिया जाना चाहिए जो कि प्रतिक्रिया के साथ हस्तक्षेप करता है।
तो अलग से विटामिन का समाधान तैयार करें, औरनमक का एक समाधान, नीली विट्रियल का एक समाधान, नमक के समाधान के साथ मिलाया जाता है, जिसके परिणामस्वरूप हरे रंग के रंग का समाधान होता है। फिर हम इस हरी समाधान में एल्यूमीनियम पन्नी का एक टुकड़ा फेंकते हैं, बुलबुले इसके चारों ओर दिखाई देते हैं - यह हाइड्रोजन है। यह भी ध्यान रखें कि पन्नी एक लाल कोटिंग के साथ कवर किया गया है, समाधान से इस एल्यूमीनियम विस्थापित तांबा निजी प्रयोजनों के लिए हाइड्रोजन को इकट्ठा करने के लिए, एक डाट के साथ एक बोतल का उपयोग करें, जिसमें पहले से कोई विस्तृत ट्यूब न डाली गई है, जिसके माध्यम से गैस बच जाएगी
और अब, ध्यान! सावधानियां। चूंकि हाइड्रोजन एक विस्फोटक गैस है, इसके साथ प्रयोगों को सड़क पर पूरा करने की आवश्यकता होती है, और दूसरी तरफ हाइड्रोजन उत्पादन प्रतिक्रिया उच्च गर्मी के रिलीज के साथ होती है, तो समाधान छप सकता है और आप बस जला सकते हैं।
हाइड्रोजन पेरोक्साइड कैसे प्राप्त करें
- प्रयोगशाला में, हाइड्रोजन पेरोक्साइड प्रतिक्रिया द्वारा निर्मित होता है: बाओ2 + एच2अतः4 = बासो 24 + एच2हे2.
- औद्योगिक पैमाने पर, यह सल्फ्यूरिक एसिड के इलेक्ट्रोलिसिस द्वारा निर्मित होता है, जिसके दौरान एसिड का गठन होता है, जो परिणामस्वरूप, सल्फ्यूरिक एसिड और हाइड्रोजन पेरोक्साइड में विघटित होता है।
- प्रयोगशाला में हाइड्रोजन कैसे प्राप्त किया जाता है: अक्सर प्रयोगशाला में हाइड्रोजन जिंक और हाइड्रोक्लोरिक एसिड के संपर्क से प्राप्त होता है: जेड + 2 एचसीएल = एच2 + ZnCl2.
मुझे आशा है कि इस अनुच्छेद से आपने जो सूचना की आवश्यकता थी, और एक बार फिर से आपको चेतावनी दी है - हाइड्रोजन के साथ किसी भी प्रयोग और प्रयोगों से सावधान रहें!